疾病與它們的起源
精準醫療在台灣 ft.國家衛生研究院
一切的開始
1953年,美籍科學家詹姆斯.華生(James Watson)和克里克(Francis Crick)、威爾金斯(Maurice Wilkins)發現了DNA的雙股螺旋結構,並於數年後獲得諾貝爾生理醫學獎,開啟了人類基因研究的先河。
1990年代「人類基因體計畫」啟動,研究者開始探索,並且逐漸瞭解人類基因中隱藏的秘密。2003年,人類基因圖譜大致出爐。科學家至此開始了解,人類共有約2萬組基因,組成46條染色體;也知道人類基因不僅與其他物種不同,且極具多樣性:族群之間基因突變型態與比例有所不同,同人種之基因也具有個體差異。
台灣精準醫療發展亦緊跟國際趨勢,2000年代逐漸開始發展,近年因為次世代基因定序的廣泛應用,精準醫療發展再次迎來高峰。為期四年的「健康大數據永續平台」跨部會計畫也已展開,為精準醫療打下基石。

✎ 精準醫療始於基因資料蒐集
醫學研究者於是以基因變異作為新藥研發臨床試驗的篩選條件,針對不同的基因變異,科學家著手研發新藥、新治療,不少從前的絕症已不再是絕症,「精準醫療」的發展順勢而生。2004 年,表皮生長因子受體(EGFR)基因突變和肺癌標靶藥物療效的關聯性被找出。
EGFR小分子抑制劑(EGFR-TKI)剛研發出來時,因一些肺癌病人服用之後,有非常好的療效,而獲得緊急授權。隨後的研究顯示,具有EGFR突變的病人,治療效果佳,而亞洲肺腺癌患者EGFR突變的發生率較歐美高,歐美人種只有約10%肺腺癌具有EGFR基因突變;而在台灣,則有近五成的肺腺癌患者具有EGFR基因突變。也就是說,基因突變具有人種間的差異,因此,對於作用在基因突變上標靶藥物的反應,也是有人種差異的。
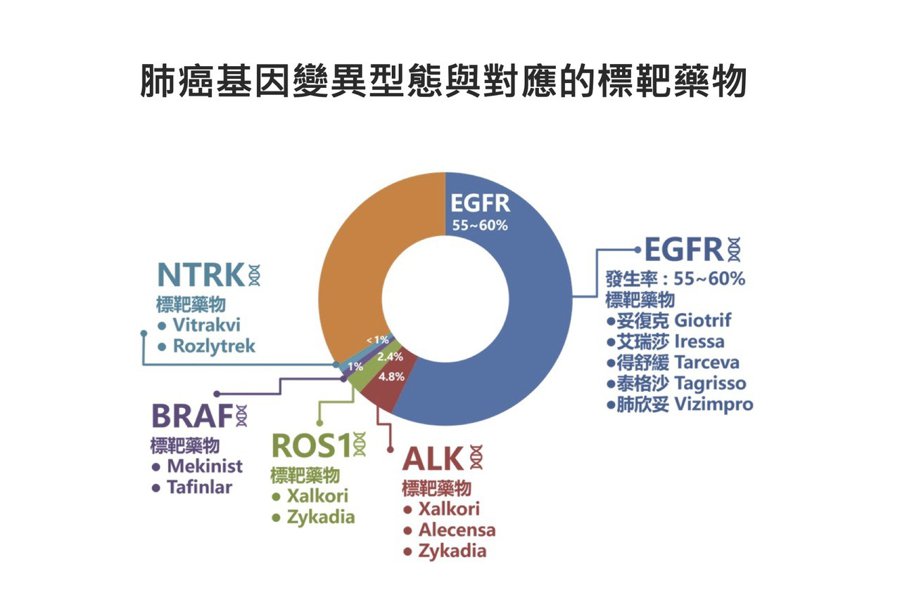
由此可見,探究本土族群的基因特徵,可說是精準醫療的基石。各國紛紛建置國家級生物資料庫,希望整合資源,投入臨床研究,嘉惠患者。然而,基因數據的研究,涉及個人隱私,亦須考量醫學倫理,必須訂定監管機制。立法院於2010年通過《人體生物資料庫管理條例》,人體生物資料庫管理者可以依法取得患者檢體,在相對嚴格的資安規範下,提供醫研界進行研究。
✎ 次世代基因定序驅動精準醫療發展
在台灣,癌症是精準醫療應用的大宗。繼肺癌之後,乳癌、胃癌、黑色素瘤等多種癌別,都已有標靶藥物可以用於治療,大幅延長患者罹癌後的存活期,以及改善患者預後。次世代基因定序(Next Generation Sequencing, NGS)是有別於傳統方法學的一系列檢測技術,能夠一次檢測數百萬條基因序列,三天內便可取得檢測結果,幫助患者迅速銜接至相對應的標靶藥物進行治療。在過去,由於次世代基因定序要價高昂,傳統基因檢測方法如:桑格定序曠日費時,且部分癌別患者檢體難以取得,故精準醫療難以發展。
如今,由於醫療科技進步,次世代基因定序成本降低,廣泛於臨床使用,也因此迎來新一波的精準醫療發展。然而,每次檢測要價仍須數萬至數十萬不等,且目前(2022年)尚未納入健保給付。雖然未來可能納保,但仍須面臨給付範圍應包括哪幾種癌別、哪些變異位點之討論。
✎ 健康大數據永續平台——精準醫療能治的不只有癌症!
精準醫療落在「精準健康」的範疇內。事實上,心血管疾病、感染症以及糖尿病等疾病,均被發現與基因變異相關,可透過精準醫療進行防治、檢測或治療。為了強化臺灣的精準醫療產業,持續建構健康大數據系統及資料分享互惠平台,2019年起,科技部(現為國科會)、衛福部、經濟部三個部會開始籌備「健康大數據永續平台」跨部會戰略計畫,並在2021年正式上路。
此計畫將建構以癌症為首的精準醫療主題資料庫,以數位科技結合生醫研究,提升國內生技、製藥等產業的國際競爭力。該計畫可分為「回溯性」與「前瞻性」兩大方向之資料庫建置。在癌症方面之資料搜集,主要由衛福部與國家衛生研究院負責。
註:「前瞻性」臨床資料意即以研究或資料蒐集為導向,依照規劃收集病人資料;由臨床醫師、護理師在治療過程中,「邊治療邊紀錄」患者不同階段之治療用藥情形及副作用或療效等,因此可以收集到符合研究需求之資料;「回溯性」臨床資料則指在治療結束後,根據電子病歷紀錄蒐集資料。通常前者之資料較為縝密完備。
國衛院研究員級主治醫師李健逢指出,健康大數據永續平台除了串連基因數據、臨床資料,亦可發揮台灣身為資通訊(ICT)強國的優勢,串連健康、亞健康,以及罹癌資料,進行健康數據建模,從治療癌症的病人,到促進國人的健康,進行連續性的努力。
現聲說法
Q&A
✎為什麼需要本土的癌症基因資料庫?
人類基因多樣性高,不同地區、族群之基因型態,以及基因變異發生的位點與比例各有不同。故國際上不少國家均已建立國家級的生物資料庫或平台:
冰島是全球第一個設立國家級基因資料庫的國家。因其人口少,研究者得以蒐集該國全部人口血液進行基因檢測,建置龐大的基因資料庫,作為該國治療藥物開發、疾病危險因子預測的基礎。冰島成功啟動基因資料庫建置後,各國紛紛仿效。其中最成功者係英國UK Biobank,蒐集50萬民眾之生物醫療數據與檢體,陸續並完成基因檢測數據,開放外界申請分析運用。
英國UK Biobank能夠成功的一個重大要素,就是成功與產業界合作,數家大藥廠投入大量經費支持,才有可能建立這麼龐大的基因數據庫,是最成功的「公私合作聯盟(Private-Public Participation, PPP)模式。
丹麥、芬蘭等社會主義國家,因社福體系完善,民眾健康數據登錄相對完善,且由政府挹注資金,加上與全國不同醫療機構合作,因此其國家級人體生物資料庫也十分成功,發表非常多優秀論文。國際大藥廠亦有貢獻大量資金來協助建立龐大基因數據庫。但丹麥、芬蘭沒有對外國人士開放,不像英國UK Biobank。韓國的國家級人體生物資料庫則與台灣的「國家級人體生物資料庫整合平台」最為相近,串連全韓國27家醫院,輔導其成立個別人體生物資料庫再予以整合。
一項新藥、新治療在引進台灣或上市使用前,須取得食藥署之藥物許可證。在過去,產業界必須透過多年的臨床試驗,取得安全性及療效之證據,才可獲得核准。近年,使用「真實世界證據(Real Word Evidence, RWE)」作為藥物許可證申請之佐證,已是國際趨勢,國內食藥署亦有相關規範。
本土癌症基因資料庫的建置,可讓患者之真實世界數據(Real Word Data)成為真實世界證據,加速藥物通過、核准;國際藥廠在引進新藥之前,亦可根據本土癌症基因資料庫進行初步的投資報酬率分析。此外,藥物取得許可後,若要納入健保亦須經過藥物共擬會議審核。本土癌症基因資料庫之療效等證據,可作為專家審查之依據,有助於全民健保的資源分配最適化。
✎什麼是「國家級人體生物資料庫整合平台(NBCT)」?
目前全台灣共有35個人體生物資料庫。其中,收案數量龐大而且數據最完整,基因數據也最多的,當屬中研院的台灣人體生物資料庫。該資料庫在2010年「人體生物資料庫管理條例」通過後成立,其收案數已達18 萬人,主要是招募社區民眾,也就是健康人。然而,疾病藥物或檢測等研究,需要的是不同疾病的患者檢體與基因數據等資料,分散在全台大各醫療院所成立的人體生物資料庫,多限制該院醫師使用,且較難進行跨癌別研究。
國家級人體生物資料庫整合平台邀集全台灣32家基因人體生物資料庫合作,建立一個龐大的生醫研究資源,對台灣的產學研醫界,提供單一窗口、一站式的服務,並簡化流程,加速檢體取得,以期促成更多臨床試驗。除了提供各種疾病類別的檢體和醫療數據,也將為各種類疾病建立基因數據庫。

✎我要如何參加「精準醫療合作計畫」?
癌友只要到與「台灣癌症臨床研究合作組織(TCOG)」合作的逾20家醫療院所就醫,便有機會透過參與相關精準醫療計畫獲得次世代定序基因檢測與治療的機會。新診斷為晚期或術後復發的癌症患者,即符合計畫參與條件,目前已納入膽管癌、食道癌、胃腸道基質瘤、甲狀腺癌等多個癌別。患者先接受NGS檢測,確認是否具有可用藥標靶基因。若無,仍可接受常規治療,同時繼續蒐集其臨床資料,做為常規治療的研究基礎。
若患者具可用藥基因變異,則須考量健保是否已給付相應的標靶藥物,及該癌別是否為適應症之一。若健保尚未給付或患者癌別未列為適應症,則可透過該計畫,轉介至可參與的臨床試驗。參與此計畫的患者,除了臨床試驗的受試同意書外,也須簽署國家級人體生物資料庫整合平台之同意書。
點擊前往:TCOG癌症臨床試驗窗口
✎是否需要擔心資安問題?
外界擔心生物資料外洩造成國安危機,「國家級人體生物資料庫整合平台(NBCT)執行長黃秀芬表示,人體生物資料庫管理條例中有資訊安全管理辦法,整合平台提供的生物資料,均依法去識別化,研究者拿到的資料僅包含歲數、性別、生物資料等,無法辨識患者身份,更不可能發生電影中殺害特定基因變異者的情況。黃秀芬也說,人類基因多樣性相當可觀,且台灣人具混種特性,外界擔心境外人士以生化武器對國人發起毀滅性生物攻擊,係華而不實的幻想。
國衛院癌症研究所研究員楊奕馨強調,NBCT基因、檢體資料整理是以分散式系統設計,將資料庫處理系統建置在各醫療院所的人體生物資料庫內,過程皆符合「人體生物資料庫管理條例」,各醫療院所的資料保存在各自的醫院內,沒有需要集中傳送到國衛院,同時對於獲得同意的申請案僅提供研究所須項目予使用者,只取出必要資料,不提供非必要資訊,是數據資料使用的最大原則。
精準醫療公私合作聯盟計畫介紹影片
國衛院計畫
「精準醫療公私合作聯盟」計畫,著重以公私合作聯盟(Public-Private Partnership,PPP)的模式,主要目標是鏈結產業界和醫研界共同合作,投入資源,在政府健康大數據永續平台的架構下,建立互利多贏的合作模式,發展癌症精準醫療價值鏈。該計畫收集之資料,未來也將放入「國家級人體生物資料庫整合平台」,作為檢體與資訊後續利用之基礎。
台灣癌症臨床研究合作組織(TCOG)計畫執行的癌症類別包括:非小細胞肺癌、膽管癌、食道癌、胃腸道基質瘤,以及甲狀腺癌,未來則規劃執行神經膠母細胞瘤、肝癌、泌尿癌、惡性黑色素瘤、人類乳突病毒陽性之口咽癌等。
▎癌症精準醫療合作計畫
精準醫療公私合作聯盟計畫,以癌症臨床試驗共享平台(TCOG為其中之一)幫助廠商加速收案,節省人力物力,來吸引廠商提出計畫並投入經費,一起進行以建置癌症精準醫療真實世界數據為導向的合作計畫。
一、收案:由健康大數據永續平台的癌症臨床試驗共享平台幫助廠商加速收案,節省人力物力,並且建立高品質的臨床資料
二、同意書:取得病人同意,將檢體和資料保管於Biobank整合平台,提供建置為資料庫及合乎法規的後續利用
三、基因檢測:進行NGS全方位基因檢測,提供病患即時檢測報告,作為臨床治療應用
四、治療評估:廠商支持之臨床試驗,針對基因突變決定最適合的治療方案
五、資料加值:收集藥物治療的效果與副作用資料,建立真實世界證據
▎癌症精準醫療合作計畫四大效益
一、產業效益:協助廠商加速臨床試驗及新藥開發
二、科學效益:建立癌症精準醫療主題資料庫,促進研究發展
三、臨床效益:促進癌症治療方法研發,嘉惠病人
四、醫療政策:協助政府進行基因檢測相關政策評估,推升產業發展
在醫療政策方面,透過國家衛生研究院「精準醫療合作計畫」取得的研究結果,以及臨床生物資料、真實世界數據(RWD)等,亦可提供衛生福利部,針對高價的基因檢測、標靶治療納入健保給付之政策評估,協助健保資源更有效率的分配。
▎廣徵產業界共同挹注資源
國衛院將繼續廣徵產業界參與「精準醫療合作計畫」,除了造福癌症病友,加速癌症治療及藥物之研發外,也期望台灣健全完善的醫療服務體系與大數據的優勢能更進一步提升。 讓台灣精準醫療網持續吸引更多國際醫療產業加入,共同合作促進個人化精準醫療的蓬勃發展。





專題策劃|聯合報健康事業部
專題企劃|韋麗文
文字採訪|林琮恩、蘇湘雲
美術設計|林琮恩、滾宬瑋




